Innovatiivinen ratkaisu suureen ongelmaan
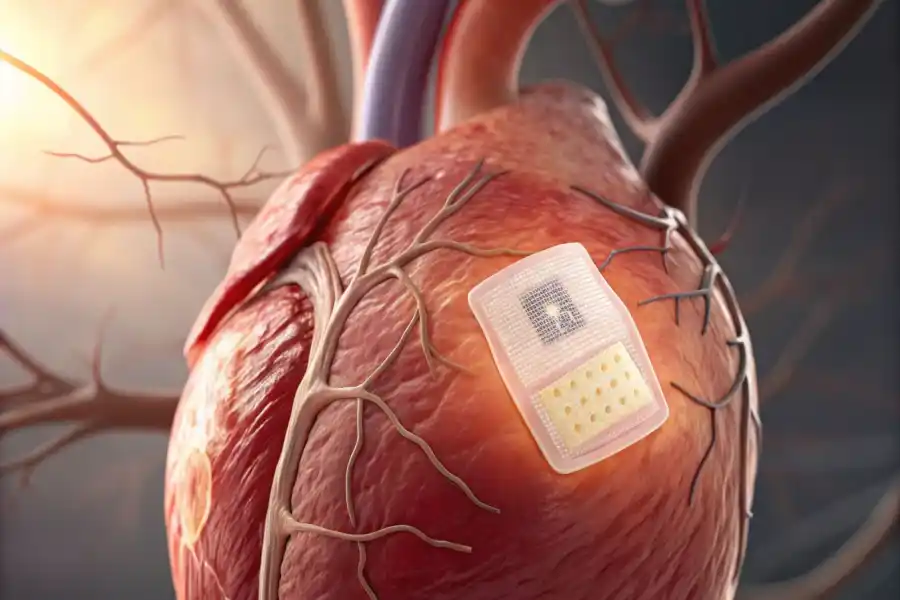
Sydämen vajaatoiminta, joka johtuu usein sydäninfarktista, kohonneesta verenpaineesta tai sepelvaltimotaudista, heikentää sydämen kykyä pumpata verta tehokkaasti. Sen vakavimmissa muodoissa vaihtoehdot rajoittuvat sydämen apulaitteisiin tai sydämensiirtoon, jotka ovat raskaita ja rajallisesti saatavilla olevia ratkaisuja.Tässä kontekstissa Göttingenin yliopistollisen sairaalan tutkijat Saksassa ovat kehittäneet biologisen sydänlaastarin. Se levitetään suoraan sydänlihakselle ja on suunniteltu palauttamaan osa sydämen supistuskyvystä integroitumalla vähitellen alkuperäiseen kudokseen.
Solujen kantasoluista syntynyt suunnittelu
Tutkijat ovat käyttäneet ihmisen verisoluja, jotka on ohjelmoitu uudelleen monikykyisiksi kantasoluiksi, jotka pystyvät eriytymään sydänsoluiksi. Tämä prosessi on mahdollistanut sydänlihaksen kudoksen luomisen, joka on samanlainen kuin kahdeksanvuotiaan lapsen sydän, ja joka kykenee supistumaan ja tukemaan sydämen toimintaa.Laastari, joka on integroitu kollageenigeeliin, istutetaan minimaalisen invasiivisella leikkauksella. Se kohdistuu terminaalista sydämen vajaatoimintaa sairastaviin potilaisiin, joiden kuolleisuusaste on noin 50 % vuoden sisällä.
Ensimmäiset rohkaisevat tulokset
Kliiniset kokeet ovat jo osoittaneet lupaavia tuloksia. 46-vuotias potilas, jota on hoidettu tällä laastarilla, on nähnyt sydämensä verisuonituksen parantuneen merkittävästi. Lisäksi sydämen vajaatoimintaa sairastaville riikinkukkoapinoille tehdyt testit ovat paljastaneet merkittävän lisääntymisen vasemman kammion ejektiofraktiossa, joka on keskeinen sydämen toiminnan indikaattori.Istutus ei ole aiheuttanut rytmihäiriöitä tai kasvaimen kasvua, mikä vahvistaa sen turvallisuuden. Laastarin verisuonitus ja solujen säilyminen on havaittu kuuden kuukauden aikana, mikä viittaa pitkäaikaiseen hyödylliseen vaikutukseen.
Laajempi kliininen soveltaminen mahdollisuuksien mukaan?
Viiden vuoden kuluessa tämän tyyppinen solusiirto voisi olla saatavilla edenneestä sydämen vajaatoiminnasta kärsiville potilaille. Tutkimuksen johtajan professori Wolfram-Hubertus Zimmermannin mukaan suurin haaste on tuottaa ja istuttaa riittävä määrä sydänlihassoluja samalla kun vältetään komplikaatiot.Sydäntautien lisäksi tämä lähestymistapa voisi avata mahdollisuuksia muilla lääketieteen aloilla, kuten hermo- tai lihaskudoksen korjaamisessa.
Vaikka lisätutkimuksia tarvitaan istutettujen solujen kypsyyden ja vaikutusten keston arvioimiseksi, tämä biologinen laastari edustaa jo merkittävää edistystä sydämen vajaatoiminnan hoidossa.
Lisätietoja: Miten kantasolut ohjelmoidaan sydänlaastarin luomiseksi?
Tutkijat käyttävät aikuisen verisoluja, jotka ohjelmoidaan uudelleen monikykyisiksi kantasoluiksi erityisten transkriptiotekijöiden avulla. Nämä solut palauttavat näin alkion kaltaisen tilan, mikä mahdollistaa niiden eriytymisen toiminnallisiksi sydänsoluiksi, jotka kykenevät supistumaan ja integroitumaan potilaan sydänkudokseen.Kun solut on ohjelmoitu uudelleen, niitä kasvatetaan kontrolloidussa ympäristössä, joka jäljittelee sydämen kehityksen olosuhteita. Tämä edistää niiden kypsymistä ja järjestäytymistä elinkelpoiseksi lihaskudokseksi, jolla on supistuskyky, joka on verrattavissa kasvavan sydämen kykyyn.
Tavoitteena on saada aikaan riittävän vakaa ja toiminnallinen kudos, joka voi sopeutua ihmisen sydämen vaatimuksiin. Uudelleen ohjelmoidut kantasolut avaavat joustavuutensa ansiosta mahdollisuuksia regeneratiiviseen lääketieteeseen, sydäntautien lisäksi, ja niillä on potentiaalisia sovelluksia muille vaurioituneille elimille.